Actualizado diciembre 22, 2017
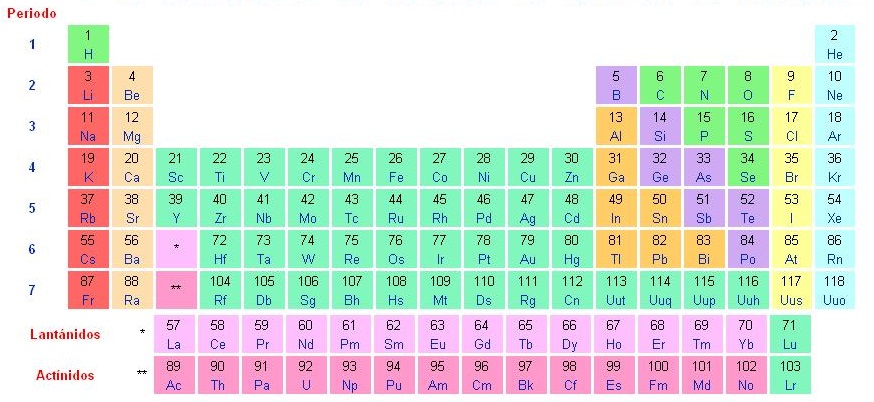
Más conocida como la tabla periódica, específicamente deberíamos hablar de la tabla periódica de los elementos químicos. En términos generales tenemos que describirla, tal como su nombre lo indica, como una tabla en la cual se encuentran ordenados todos los elementos químicos siguiendo un ordenamiento específico, que está dado en base al número atómico (que luego explicaremos con detalle a qué se refiere el mismo), las propiedades químicas y la configuración de electrones. Esta organización lo que permite es que haya en la table sectores, llamadas tendencias periódicas, que se caracterizan por reunir elementos que tienen un comportamiento similar de acuerdo a sus propiedades y que están organizados en la misma columna. Pero esto solo como un panorama general, porque a lo largo de este post vamos a dedicarnos a hablar de cada una de las características de la tabla periódica, por eso te invitamos a que continues leyendo este post en el que encontrarás información completa e imágenes de la tabla periódica de los elementos químicos.
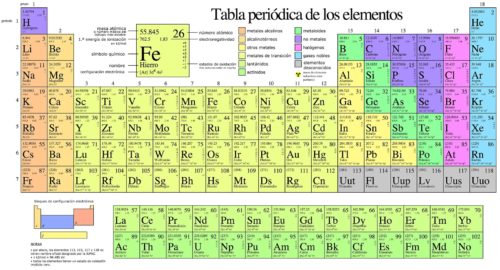
Tabla periódica de los elementos químicos
Historia de la Tabla periódica
Desde la aparición del estudio de la química y los especialistas dedicados a ella, es decir los químicos, se ha empezado a notar que había ciertos elementos de este sector de la ciencia tenían comportamientos y propiedades similares. La historia de la tabla periódica tal como la conocemos hoy en día data de muchos años atrás, llevándonos al año 1800.
Concretamente fue un químico nacido en alemania, Döbereiner quien en el año 1829 condujo el primer acercamiento a esta tabla. Lo que el hizo fue hacer un agrupamiento de algunos elementos químicos para poder empezar a hacer un orden en estos. A través de sus trabajos puso en evidencia que había elementos que tenían algunas semejanzas, como es el bromo, el iodo y el cloro. Y al mismo tiempo puso al descubierto que había propiedades regulares en todos que iban variando de unos a otros. Un ejemplo de éstas es el peso atómico. No pasó mucho tiempo hasta que se empezara a pesquisar estas semejanzas en otros elementos, como el bario, el calcio, etc. No obstante, los trabajos de este químico se desestimaron, sobre todo porque se hablaba de propiedades como la del peso atómico cuando éste aún no tenía un significado específico y porque todavía quedaban muchos elementos por conocer.
Así es como durante la década del ´50 al ´65 de esa misma época empezaron a descubrirse nuevos elementos químicos y hubo notorios progresos para determinar las propiedades de estos, como la masa atómica. Pero debemos situar específicamente el año 1864, de la mano de Newlands, quien postuló la ley de octavas. Lo que el hizo fue ordenar los elementos hasta aquí conocidos de acuerdo al peso atómico y luego los ordenó en columnas en sentido vertical que tenían 7 elementos cada uno. En este ordenamiento pudo identificar que en sentido horizontal había coincidencia entre los diferentes elementos respecto a sus propiedades y que mostraban una variación regular Sin embargo se terminó desestimando sus trabajos, por el hecho de que sostenía que todas las columnas tenían que tener la misma longitud y esto llevaba a que coincidan en sentido horizontal elementos con propiedades diferentes.
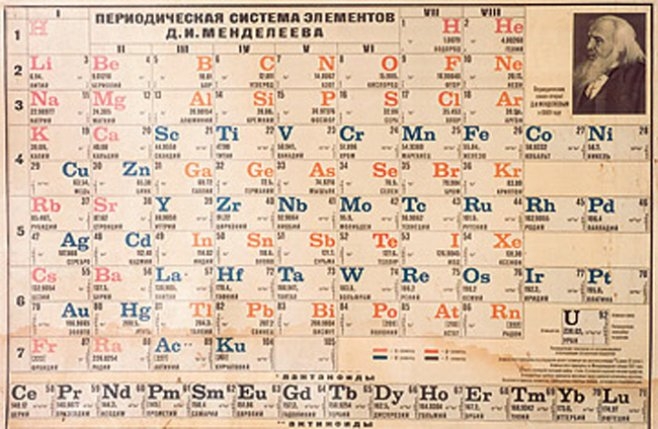
Pero algunos años más tardes podemos situar la aparición de la primer Ley Periódica, de la mano de otro químico alemán, J. L, Meyer y un químico ruso, D. I. Mendelyev. Lo que interesan son los hallazgos de éste último, que empezó a utilizar el criterio de la valencia en los diferentes elementos y el peso atómico. Éste postuló su trabajo en el formato de una tabla, donde los periodos se rellenaban tomando como eje las valencias de los elementos que iban a aumentar o bajar armoniosamente dentro de los diferentes periodos. Este nuevo orden lo que permitía era lugar a un grupo de elementos que tenían propiedades químicas semejantes pero que diferían en las propiedades físicas.
La aparición en escena del espectrógrafo permitió que se descubrieran nuevos elementos, que fueron agregándose a la tabla, incluyendo los gases nobles que también tuvieron un lugar en la tabla. Así fue como la tabla propuesta por Mendelyev se aceptó mundialmente y la tabla que se utiliza en la actualidad es muy semejante a la que él creó hace un siglo, salvando las diferencias por el descubrimiento de propiedades cuánticas y nucleares de los elementos.
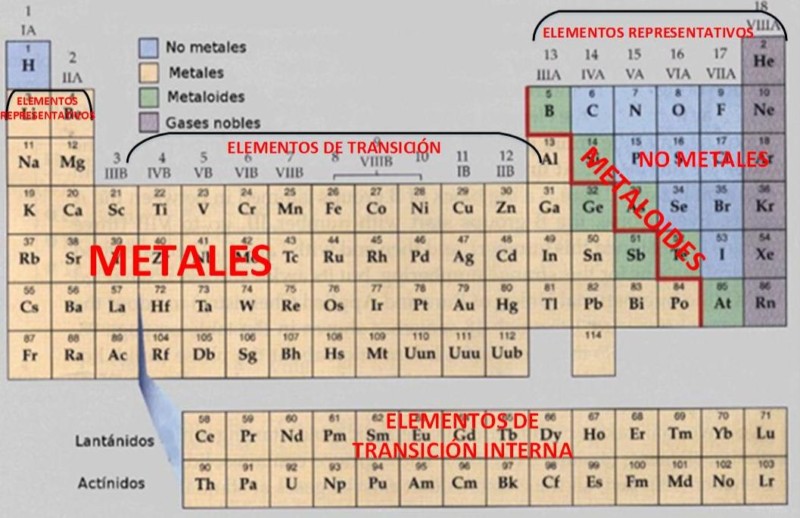
Debemos mencionar a Glenn Seaborg, quien introdujó cambios significativos en la tabla periódica durante el S. XX, dado por el descubrimiento en el año 1940 de plutonio y de otros elementos trasuránidos, como el Curio, Californio, Fermio, Nobelio, etc. Además, luego agregó la serie de los elementos actnínidos por debajo de la de los lantánidos.
Clasificación de los elementos de la Tabla periódica
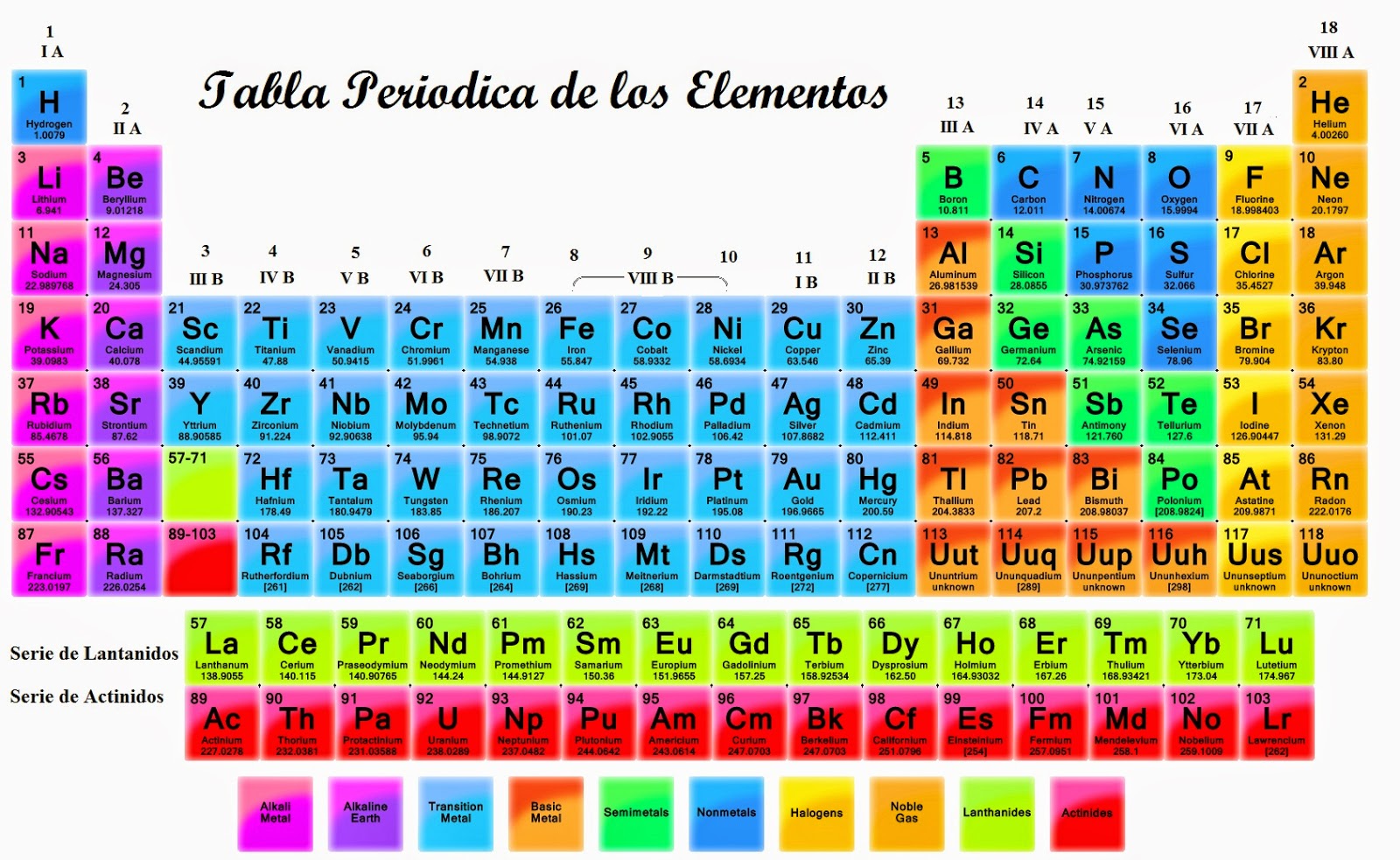
La clasificación de los elementos que componen la tabla periódica se puede dar a partir de distinguir las propiedades químicas y físicas que tienen los diferentes grupos de elementos. La clasificación más conocida es la que establece la distinción de 3 grandes categorias:
- Metales: Dentro de éste encontramos además una subdivisión
- Por un lado los metales alcalinos. Aquí encontramos los elementos del grupo 1, incluyendo desde el Litio hasta el Francio, aunque debemos exceptuar el Hidrógeno, que se lo clasifica como un no metal, debido a que tiene pocas propiedades metálicas.
- Por el otro los metales alcalinotérreos. Se trata del grupo 2 y comprende los elementos que van del Berilio hasta el Radio. Se caracterizan por tener un alto punto de fusión y sus compuestos óxidos arman soluciones alcalinas.
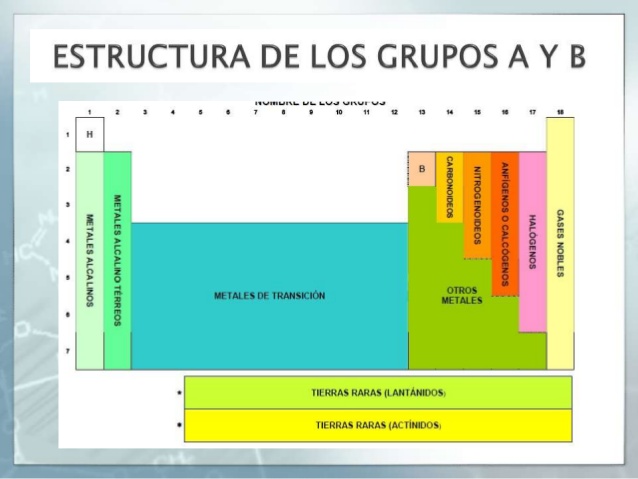
- Los lantánidos. Comprende desde el lantano hasta el lutecio.
- Actínidos. Implica el grupo desde el elemento 89 hasta el 103. La característica de estos elementos es que son radioactivos, que no se encuentran en abundancia, con la excepción del uranio y el torio que se encuentran naturalmente en cantidades importantes.
- También componen los metales de transición, que están en el centro de la tabla y comprende el grupo 3 al 12.
- Por último los postransicionales, también conocidos como otros metales, tienen la característica de ser metales pero con propiedades de éstos no tan fijas si no más bien moderadas.
2. Metaloides. que se tratan de elementos que tienen propiedades que varían entre los metales y los no metales. También se conoce a estos elementos como semimetales.
3. No metales. Se encuentran todos los demás elementos y se distinguen los gases nobles y los halógenos. También se usa para los elementos no metálicos que no pueden clasificarse dentro de los subgrupos de esta categoria, como el nitrógeno, oxígeno, fósforo, hidrógeno, azufre y silenio.
- Los elementos halógenos están reunidos en el grupo 17 y tienen la característica de ser muy reactivos y por eso tienden a estar en la naturaleza con otras sustancias y excepcionalmente en estado puro.
- Y los gases nobles están representados en el grupo 18. Estos elementos se presentan en estado gaseoso, no tiene color, olor y tienen la propiedad de ser inertes químicamente por que tienen mucha estabilidad.
Grupos de la Tabla periódica
Como dijimos al comienzo, la tabla periódica se trata de una representación gráfica de los elementos químicos que se encuentra organizada en columnas y filas y de esta manera se obtiene valiosa información sobre los elementos.
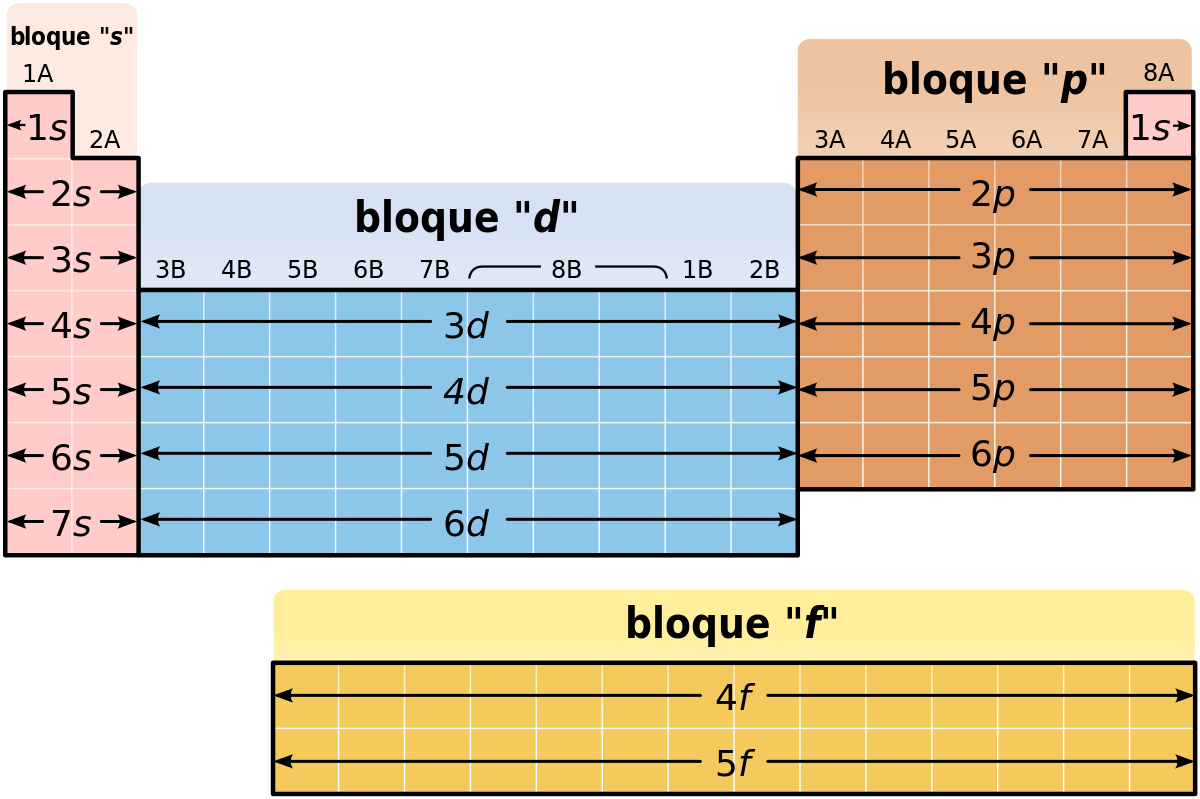
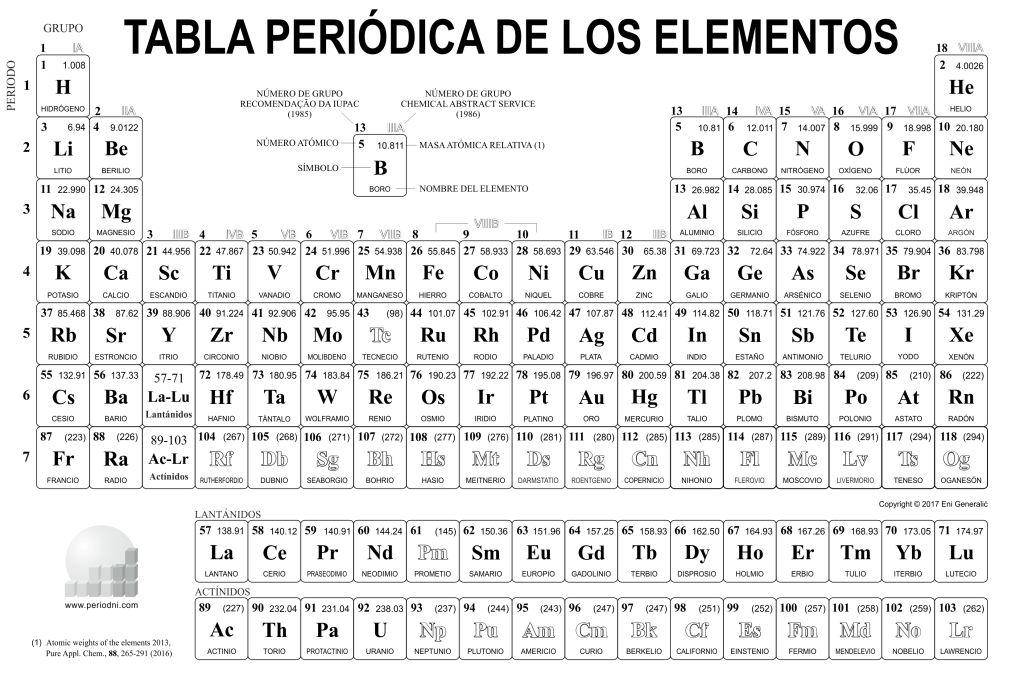
Respecto a los grupos, éstos están representados en las columnas de la tabla, habiendo 18 grupos en total. Estos grupos a su vez, se encuentran agrupados en grupos más grandes, llamados bloques, que hay un total de 4, pero de eso te hablaremos más adelante.
Cada uno de estos grupos reúne lo que se ha llamado familia de elementos químicos, y esto significa que aquellos elementos que se encuentran en un mismo grupo comparten configuraciones electrónicas semejantes en los niveles de energía más exteriores. Pero además estos elementos tienen propiedades físicas y químicas similares, y esto se debe a que éstas dependen de manera directa de las interacciones que se dan entre los electrones de los órbitas externas, y como estos elementos suelen tener configuraciones parecidas, esto explica las semejanzas de las propiedades.
Los grupos están directamente relacionados con la clasificación, esto es:
- el grupo uno se corresponde con los metales alcalinos
- el grupo dos con los metales alcalinotérreos
- Del grupo 3 al 12 encontramos los metales de transición
- El grupo 13 con los metales térreos
- El grupo 14 con los carbonoides
- El grupo 15 con los nitrogenoides
- El grupo 16 con los calcógenos
- el grupo 17 con los halógenos
- El grupo 18 con los gases nobles
Es importante aclarar que actualmente las denominaciones que van del grupo XIII al XVI no se usan más.
Períodos de la Tabla periódica
Los períodos corresponden a las filas de la tabla período. Éstos se encuentran numerados de manera descendente del 1 al 7, esto significa que el período 1 es el superior y el inferior es el 7. Pero para ser más específicos, el período lo que viene a determinar es el número de niveles energéticos que tiene un átomo, lo que implica que un átomo con 3 niveles energéticos tiene el número de período 3. Entonces, el número de período lo que nos viene a indicar es cuatas capas electronicas tiene un elemento, haciendo referencia a la última. Por lo que un elemento que se encuentra en el período 5 nos está indicando que tiene 5 capas electrónicas.
Aquellos elementos que se encuentran en el mismo período tienen semejantes en la electronegatividad, en la afinidad electrónica, el radio atómico y la energía de ionización.
Dijimos que hay 7 períodos y cada uno de ellos reúne diferentes elementos, a saber:
- El primero de ellos está compuesto por 2 elementos
- El período 2 y el 3 tienen 8 elementos
- El período 4 y 5 tienen 18 elementos
- El período 6 tiene 32 elementos
- El período 7 no cuenta con los 32 elementos porque se encuentra incompleto. Esto se debe a que los últimos dos períodos tienen 14 elemetnos separados con el objetivo de no extender demasiado la tabla para que el trabajo en ella sea más práctico.
Bloques de la tabla periódica
Hace un momento mencionábamos que los grupos -las columnas de la tabla periódica- se reúnen a su vez en cuatro bloques que se encuentren diferenciados por letras. Por lo tanto, los bloques vienen hacer otra división de la tabla periódica que viene a demostrarnos la manera en que se van llenando las capas electrónicas de los elementos con electrones. Es decir, estos cuatro bloques se forman de acuerdo a la última órbita de los elementos. Así distinguimos cuatro bloques, s, p, d, f.
- Bloque s: En este bloque encontramos los 2 primeros grupos, junto con el helio y el hidrógeno.
- Bloque p: Comprende los otros seis grupos.
- Bloque d: Abarca todos los metales de transición.
- Bloque f: comprende los antánidos y actínidos y se encuentra debajo de la tabla generalmente, y no cuenta con números de grupo.
Tabla periódica para imprimir
Tabla periódica en blanco y negro para colorear
Curiosidades de la Tabla Periódica
Hay algunas cuestiones básicas que se tienen que conocer a la hora de leer la tabla periódica. Es llamativo porque se dice «leer» como si se tratara de párrafos y letras. Sin embargo, como ya veníamos mencionando, se trata de una representación gráfica, que carece de párrafos, ya que sólo se limita a transmitir información por medio de números, símbolos y nombres de los elementos. Y se sabe leer esto, podemos obtener valiosa información de cada uno de estos elementos, conociendo su número atómico, su masa atómica, la manera en que actúan, interactúan y reaccionan.
Para leer esta tabla debemos hacerlo comenzando por la izquierda y yendo hacia la derecha, y desde arriba para abajo. El número atómico va a ir decreciendo, como así la masa atómica, con determinadas excepciones.
Sin duda alguna la tabla periódica se trata de una valiosa herramienta para todos aquellos que trabajan en la química y ciencias a fines. Pero probablemente hay muchas curiosidades de ellas que aún siendo grandes estudiosos de esta ciencia, desconocen. Una de ellas tiene que ver con que la primer versión que se publicó en 1869 contenía tan sólo 69 elementos que eran los conocidos y los que habían sido descubiertos hasta el momento. En la actualidad en total son 118 elementos los que se pueden encontrar.
Otra curiosidad tiene que ver con el nombre de algunos elementos, que llevan el hombre de países, tales como Francio, Polonio, Germinaio, Niponio, etc. En esta misma línea hay elementos que representan el nombre de continentes, como es el caso de Americio y Europio. También han sido representados cuerpos celestes en la tabla con el nombre de elemtnos como el Neptunio, Plutonio y Uranio. No podemos dejar de mencionar elementos como Einstenio, que viene a ser un homenaje a uno de los más importantes científicos de la historia, como es Einstein, y también Copérnico, representado en el elemento Copernicio.
Y por último, sabías que en la tabla periódica, habiendo muchas letras, no se encuentra ninguna J.