Actualizado septiembre 19, 2020
La materia siempre ha interesado como tema al hombre, que en definitiva está compuesto por ella. Si bien la historia a dado lugar a diversas definiciones, a continuación presentamos información de la materia y sus estados: definición, sólido, líquido, gaseoso, plásmático y otros.
¿Qué es materia?
Vivimos en un mundo material podríamos decir ¿Acaso no vemos aquella roca? ¿No observamos nuestro cuerpo y el ajeno? Por supuesto ¿Entonces qué es la materia? Un sinnúmero de definiciones han existido sobre este tópico, pero a grandes rasgos se puede decir que es todo lo que ocupa o se extiende en una región espacio- temporal, que posee energía, está sujeto a cambios en el tiempo y se lo puede estudiar con diversos aparatos de mediciones. De algún modo, pese a la complejidad de algunos estados de materia (no es lo mismo el sólido que el gaseoso o el plasmático), se llega a la conclusión que la misma tiene cierto rasgo de ser sensible en tanto objeto, es decir es perceptible o detectable por el sujeto a través de distintos medios, tan diferentes como el simple ojo o una experimentación científica de laboratorio del primer nivel.
Históricamente la materia ha sido entendida como un fundamento, un origen y hasta una presencia. De hecho, materia es una palabra en latín y alude a «la sustancia de la que están hechas las cosas» y también, desde un punto más cercano, a la misma madera del interior de un árbol. La sustancia, como terminología filosófica y luego teológica, alude a lo que es, a lo subyacente o hasta podríamos decir esencial, por lo tanto nunca puede ser un atributo, un predicado o un accidente. Materia proviene de mater, que es origen, fuente y madre y se corresponde muy bien con el griego hyle, que alude al bosque y a la leña.
Por lo que se vislumbra, la materia siempre ha sido un elemento importante del raciocinio humano. A los filósofos milesios le interesaban saber si contaba con un origen único o tenía diversas fuentes, para el atomismo todo se reducía a una unidad indivisible llamada átomo, para Aristóteles la materia era aquello receptivo a la forma (el famoso hilemorfismo), el materialismo postulaba como la verdad del ser a la materia, lo primario e incluso diversas culturas ajenas a Occidente han entendido a lo material como lo invariante frente a las cambiantes apariencias. Sin embargo, en la actualidad la ciencia ha modificado mucho la realidad de la materia, a tal punto de afirmar que solo el cinco por ciento del universo está compuesto por materia másica ordinaria. Esta sería parte de la materia bariónica, que está en proporciones muy reducidas comparado con la materia oscura y la inefable energía oscura, que incluso hoy es una gran incógnita y se asocia con el proceso de inflación del universo (algo muy distante del cerrado universo aristotélico).
Estados de agregación de la materia
Pero la materia no tiene una única forma de presentarse al hombre, por lo que cualquier sustancia o mezcla, por ejemplo, bajo distintos niveles de presiones o temperaturas da lugar a diversos estados o fases. Estos son los famosos estados de agregación de materia. A continuación, si se quiere, se comienzan con los clásicos, es decir, aquellos que usualmente el ser humano encuentra en la naturaleza.
El estado sólido
El estado sólido es sumamente familiar, porque los cuerpos se presentan de una manera definida. Es decir, sus átomos están entrelazados en estructuras concretas, soportando fuerzas sin una deformación aparente. Este estado de agregación da lugar a una materia dura, resistente, en donde la fuerza de atracción es mayor que la de repulsión. Para no complejizar en exceso: hay cohesión, definición o memoria de forma (si se da una configuración fuera de lo normal hay restitución a veces), incompresibles (algo que se puede relativizar de todos modos), con un fluido bajo o nulo y una resistencia a la fragmentación.
El estado líquido
Si, por ejemplo, se aumenta la temperatura del sólido, esa estructura concreta o definida comienza a desaparecer, alcanzando un estado fluido. Este es un rasgo que permite adaptar, por ejemplo, el contenido al continente o recipiente, por ejemplo, el agua en un vaso. Naturalmente, hay unión entre átomos, pero es menos intensa. Por lo tanto: hay una cohesión menor, energía cinética, sin forma definida o memoria, una realidad difusa y poco compresible.
El estado gaseoso
En este estado de agregación los elementos fundamentales están separados, desperdigados y con poco nivel de atracción, lo que hace que los gases no tengan un volumen determinado ni una forma definida y se puedan expandir libremente hasta llenar el recipiente que lo contiene. Hay un estado de caos y poca respuesta a la gravedad, por lo que se puede comprimir el gas de manera fácil, lo que significa achicar la distancia de sus partículas nucleares o elementales.
El estado plasmático
El plasma es un gas absolutamente ionizado, es decir, los átomos que lo componen se han desligado de alguno de sus electrones. Este estado de agregación es como un gas, formado con aniones y cationes, que para que se entiendan, son iones que han ganado o perdido electrones, separados entre sí y libres. Por lo tanto, si las temperaturas son muy altas, los átomos de estos gases especiales colisionan y pierden electrones, de ahí que en la atmósfera solar el gas se comporte en verdad como un plasma. A diferencia de los gases fríos, el plasma es un excelente conductor de electricidad y está influido por los campos magnéticos.
Otros estados de la materia
Pero el ser humano, con su gran curiosidad, ha logrado formar otros estados de materia. Es decir, a continuación hablaremos de agregaciones que no se hallan, a priori, en la realidad, sino que son producto de un experimento de alto vuelo científico.
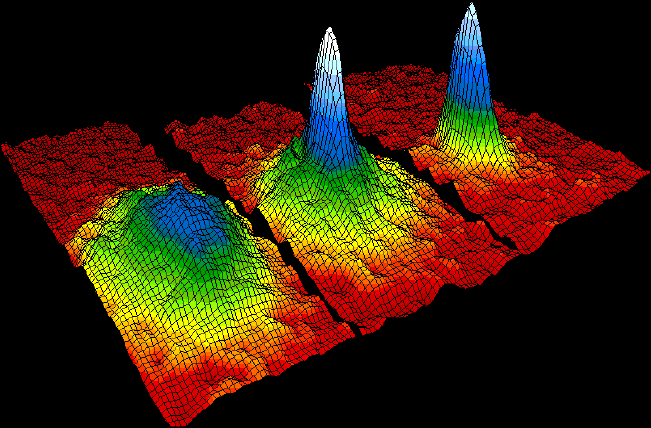
Estado condensado de Bose-Einstein
Esta nueva forma de materia fue obtenida en 1995 por un grupo de científicos. Ellos lograron enfriar los átomos a una temperatura 300 veces más baja de los que se había obtenido anteriormente (por debajo de la mínima hallada en el espacio exterior), por lo que el resultado es un estado tan denso y tan frío que hasta los átomos pueden quedar inmóviles ¿Y por qué se lo denomina Bose- Einstein? Porque en verdad estos dos fabulosos científicos lo predijeron bastantes décadas previamente.
Estado condensado de Fermi
Este condensado, como otro estado de agregación, es algunos años más reciente (ideado en 1999 y creado en 2003). Este es una fase superfluida formada por partículas fermiónicas a temperaturas bajas y a diferencia del estado anterior los fermiones condensados se conforman utilizando fermiones en lugar de bosones. La denominada superfluidez se adquiere a temperaturas muy bajas también.
Estado supersólido
Este material se produce con los átomos del helio cuando en su totalidad están congelados, componiendo una película cristalina rígida, en una forma similar como están los átomos y moléculas en un sólido normal como el hielo. El rasgo sorprendente de este nuevo estado de agregación es que congelado no quiere decir estacionario. Es que el helio está tan frío que comienzan a imperar las leyes de incertidumbre cuántica y eso quiere decir que los elementos del helio funcionan como si fueran sólidos y fluidos a la vez, de ahí su nombre (un fluído que se mueve como si no tuviera ninguna fricción, aunque no deja de ser sólido).
Cambios de estado de la materia
Cada elemento o compuesto químico tiene una determinada condición que, en términos simples, hace que sea lo que efectivamente es. Pero si se modifica la temperatura y la presión, por ejemplo, encontramos modificaciones. A continuación presentamos los nombres y rasgos de cada uno de los cambios de materia.
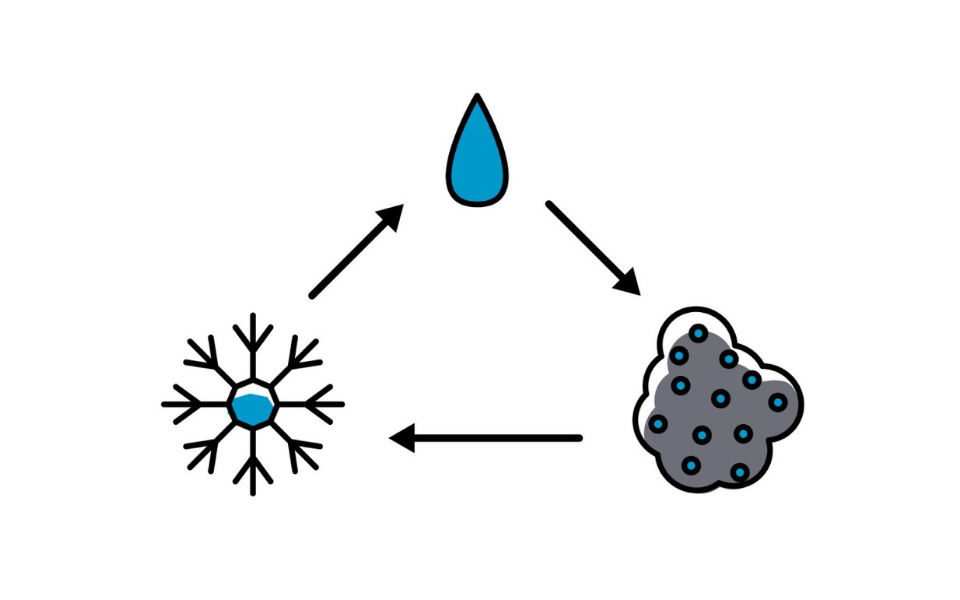
- Fusión: Así se denomina el pasaje de un sólido al estado líquido por medio del calor. Este proceso endotérmico, es decir, que absorbe energía para la modificación, da lugar a un punto de fusión, que es la temperatura en la que el sólido se funde, la cual varía de acuerdo a la sustancia con la que se trabaje. Posiblemente el ejemplo más sencillo es el hielo derritiéndose.
- Solidificación: Es un proceso exotérmico, ya que desliga calor. Aquí, por lo tanto, se halla el pasaje de un líquido a un sólido por medio del enfriamiento. Por lo tanto, hay un punto de solidificación, que es la temperatura en la cual el líquido se congela y permanece constante.
- Vaporización y ebullición: Aquí el líquido pasa a estado gaseoso. Por lo tanto, la temperatura del total del líquido iguala al punto de ebullición del líquido a esa presión. Lo curioso es que si se sigue calentando el líquido este absorbe el calor, es decir, no hay un aumento de la temperatura, ya que el calor se emplea para pasar el estado de agregación de la materia de líquida a gaseosa. Por lo tanto, hay un calor sensible y otro de ebullición o vaporización.
- Condensación: Es el cambio del estado de materia que pasa de forma gaseosa a líquida. Es decir, es inverso a la vaporización. Aquí se puede pensar, como ejemplo, en un bidón (recipiente para poner agua) que por diferencia de temperatura entre el interior y el exterior, genera una humedad en su superficie.
- Sublimación: Este pasaje de materia se da desde el sólido al gaseoso, sin pasar por el líquido. El hielo seco es el perfecto ejemplo.
- Sublimación inversa: Contrario al anterior, ya que se pasa del gaseoso al sólido directamente, sin mediar el líquido.
- Desionización: Si el plasma es gas ionizado, es decir, con desligue de electrones, entonces este proceso de cambio de materia refiere al pasaje del plasma al gas.
- Ionización: Pasaje del estado de gas a plasma, es decir, inverso al de arriba.